読み物:ホスホロアミダイトケミストリーとTwist Bioscienceにおける役割
ホスホロアミダイトケミストリーがオリゴヌクレオチド合成や現代の分子生物学に欠かせない理由を解説します。

ホスホロアミダイトケミストリーはDNA合成におけるゴールドスタンダードの手法であり、産業界で約35年にわたり利用されてきました。そのシンプルさと高い効率性のおかげで、200塩基対までのオリゴヌクレオチド配列を大量に合成できるようになっています。現在、ホスホロアミダイトケミストリーは、大規模のDNAを合成生物学市場に供給できる唯一の商業的に実用化された技術です。ここでは、ホスホロアミダイトケミストリーがいかにDNA合成を効率化しているのかを見ていきます。
オンデマンドの合成DNAは、遺伝学、合成生物学、代謝工学の実践に欠かせません。研究者はそれを利用して生命を操作し、より深く理解することができます。合成DNAを作り出すには、自然のプロセスを模倣しつつ、カスタムオリゴヌクレオチド配列を正確に組み立てられる強固な方法が必要です。
このためDNA合成は、過去1世紀における最も重要な発見のひとつといえます。天然DNAは、繰り返し単位として並んだヌクレオチドからなる化学的な鎖であり、各ヌクレオチドは酵素の働きによって連結されています。この結合は、各ヌクレオチドに共通する3つの主要な化学成分によって可能となっています(下図参照)。
合成DNAの作製方法は、この自然のプロセスを「ホスホロアミダイトケミストリー」という確立された技術で模倣しています。この技術は長年の試練に耐えてきたものであり、この分野の基本特許は今年で41周年を迎えました。ここでは、標準的なホスホロアミダイト反応、その信頼性を支える特性、そしてTwist Bioscienceの商業プロセスにおける役割を簡単にご紹介します。
🧬 ヌクレオシドとヌクレオチドの違い
「ヌクレオシド」と「ヌクレオチド」という用語はDNAやRNAの基本構成要素としてよく登場します。両者は非常によく似ていますが、決定的な違いはヌクレオチドが5’位にリン酸基を持つことです。このリン酸基こそが鎖を形成する能力に不可欠なのです。標準的なヌクレオシドは修飾を受けない限り鎖を作ることはできません。自然界ではヌクレオシドにリン酸基を付加(リン酸化)することでヌクレオチドとなり、それらが連なってDNAを形成します。合成DNAを作る場合には、ヌクレオシドをヌクレオシドホスホロアミダイトへと変換します。
ホスホロアミダイトケミストリーとオリゴヌクレオチド合成
ヌクレオシドホスホロアミダイトが初めて報告されたのは1981年です。ホスホロアミダイトは修飾されたヌクレオシドであり、現代のDNA合成における標準的な化学物質です。これらの分子は、新しい塩基をDNA鎖に順次結合させることを可能にし、非常にシンプルかつ極めて効率的なサイクル反応によってDNA合成を実現します。
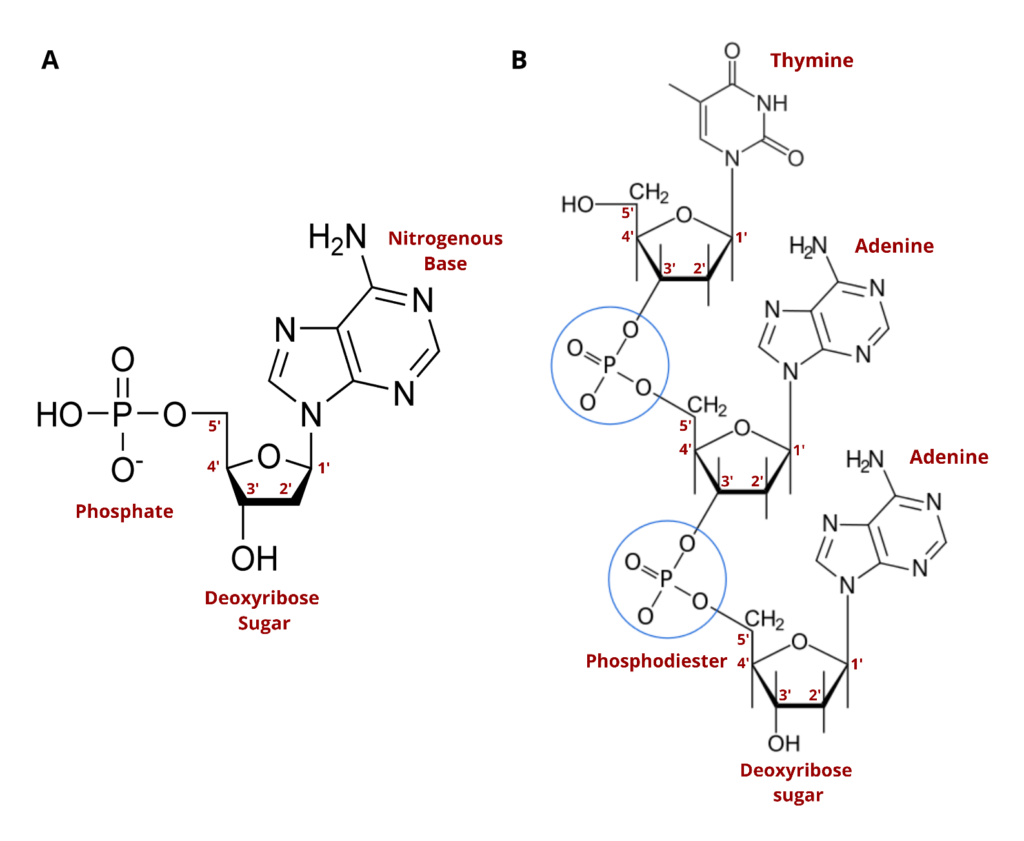
A) 1つのヌクレオチド リン酸基とデオキシリボース糖がDNAの骨格を形成し、窒素塩基(ここではアデニン)が各核酸の情報を担う単位となります。B) 一本鎖DNAの構造 自然界では酵素が隣接するデオキシリボース糖の5位と3位をつなぐホスホジエステル結合(青丸)を形成します。ヌクレオチドのモジュール性により、この鎖は無限に伸長可能です。出典:Wikicommons より改変。画像は CC BY-SA 3.0 ライセンスに基づき利用可能。
ホスホロアミダイト登場前のDNA合成の課題
ホスホロアミダイトが登場する以前のDNA合成技術は、反応効率の低さにより合成できるDNAの長さ・品質・収率に大きな制約がありました。そのため、分岐したり、途中で切れたり、変異を含むオリゴヌクレオチド配列が生成されやすかったのです(オリゴヌクレオチドの詳細はブログ「核酸オリゴが世界を変えた方法」を参照)。
さらに、合成中の鎖は不安定な中間体を経由するため、空気に触れるだけで分解してしまうこともありました。主な原因は、ヌクレオチドに余分に付加される「保護基(Protecting group)」の扱いの非効率性です。保護基は副反応を防ぎ鎖の安定性を確保するために設けられますが、逆に不安定さを招くこともありました。
保護基とDNA、そしてホスホロアミダイト化学
ホスホロアミダイトが優れている点のひとつは、最適化された保護基を組み込んでいることです。
天然のヌクレオシドはヒドロキシ基(–OH)やアミノ基(–NH₂)を豊富に持ち、それらはDNA合成に使われる他の化合物と容易に反応してしまいます。その結果、二重らせん構造というDNA特有かつ機能的に重要な形態をとらない、望ましくない分子が生じる可能性があります。
1981年にヌクレオシドホスホロアミダイトが発見され、オリゴ合成における強力なツールとなりました。標準的なホスホロアミダイト分子は、通常のヌクレオチドのリン酸基の代わりに「ホスファイト基」を持ち、さらに4種類の特定の保護基を含みます。これらの保護基は安定性を与える一方で、必要な時には容易に除去できる設計になっています。
この仕組みにより、DNA化学者は反応させたい部位だけを選択的に露出させることができ、合成化学を厳密にコントロールすることが可能となります。現在では、さまざまな特性を持ち、特定のDNA合成プロセスに最適化された修飾ホスホロアミダイトが数多く利用されています。
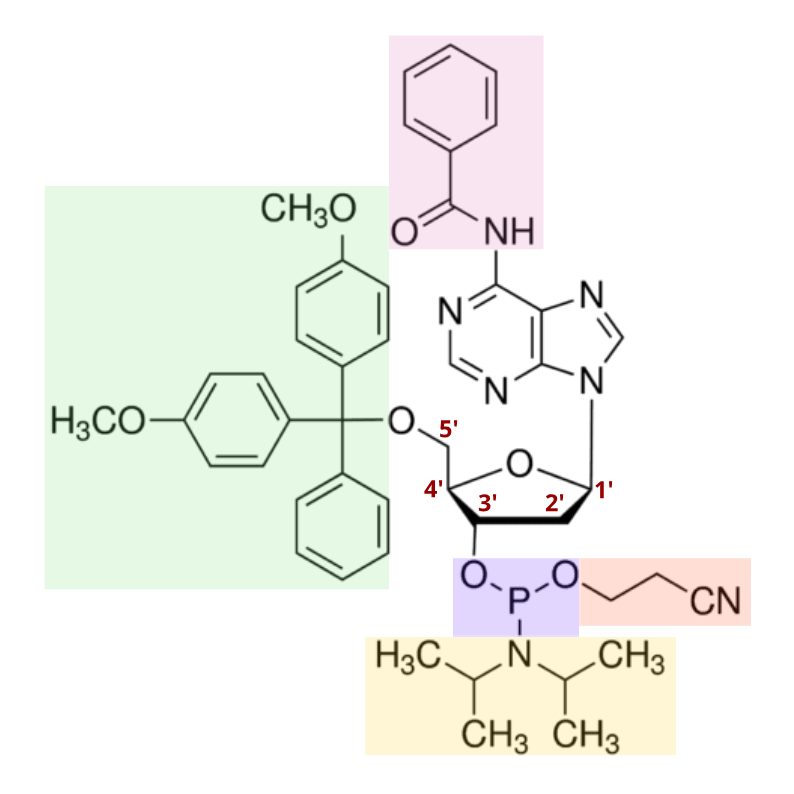
標準的な 2’-デオキシアデノシンホスホロアミダイトの構造 青:ホスホロアミダイト基。緑:ジメトキシトリチル(DMT)基。デオキシリボースの5’位ヒドロキシ基を保護し、酸性条件下で容易に除去可能。黄:ジイソプロピルアミノ基。アゾール触媒の存在下で瞬時に脱離し、ホスホロアミダイトを伸長中のオリゴヌクレオチドへ結合させる。オレンジ:2-シアノエチル基。ホスファイト上のもう一つのヒドロキシ基を保護し、温和なアルカリ条件で容易に除去可能。ピンク:塩基中のアミノ基を保護する可変基。これも2-シアノエチル基と同様に、最終段階でアルカリ条件下にて除去される。構造はPubMedより取得・改変。SID = 329774846。
ホスホロアミダイトおよびその改変体は、現在に至るまでDNA合成技術のゴールドスタンダードであり続けています。上述の図にあるように、ジイソプロピルアミノ基が除去され、中間体が脱保護されたデオキシリボースの –OH 基と反応するプロセスは非常に迅速です。その結果、ホスホロアミダイト同士は99%以上の効率で結合します。
こうした特性により、ホスホロアミダイト化学は長年にわたって信頼されてきました。1980年代後半には、オリゴヌクレオチド合成を自動化できる初期の装置が登場し、1日で1本のオリゴヌクレオチドを合成可能になりました。とはいえ、自動化や小型化に必要なハードウェアの革新が不足していたため、DNA製造は比較的小規模にとどまっていました。
自動化とミニチュア化技術
良い化学だけでは、現代市場が求めるスループットにDNAを活用することはできません。合成生物学や分子生物学の研究では、大量の合成DNAが必要とされ、数千種類もの配列バリアントを同時に試験することもあります。
そこでTwist Bioscienceは、ホスホロアミダイト化学と独自のシリコン基盤を組み合わせることを選びました。さらに、ミニチュア化、エンジニアリング、流体力学、ロボティクス、LIMS(研究室情報管理システム)の知見を活用し、DNA合成をかつてない精度と規模で自動化しています。
シリコン基盤を用いたDNA合成は「固相合成」の一形態であり、ホスホロアミダイト化学以前に確立された技術です。1965年には現代オリゴヌクレオチド合成の先駆者の一人であるRobert Letsingerがスチレン基盤を用いたDNA合成を報告しました。固相化学の登場は大きな進歩であり、各塩基を鎖に結合させた後に余分な反応成分を洗い流せるため、毎段階での煩雑な精製が不要となりました。
シリコンはDNA合成の固相支持体として非常に優れています:
- 微視的スケールで平坦 → 反応液が均一に流れる
- 硬度が高く、他の物質を付与・除去しても表面が変わらない
- 整列・パターン化・イメージングが容易
- 熱伝導性が高く、表面全体を迅速かつ均一に温度制御可能
現在の商業フローでは、100万本以上のオリゴヌクレオチドを同時に合成でき、それぞれ異なる配列を持たせることが可能です。つまり、異なる製品用途に合わせた大量合成が実現します。
Twist Bioscienceでは、独自のシリコンプラットフォーム上でホスホロアミダイト反応サイクルを用いてオリゴヌクレオチドを合成しています(下図参照)。
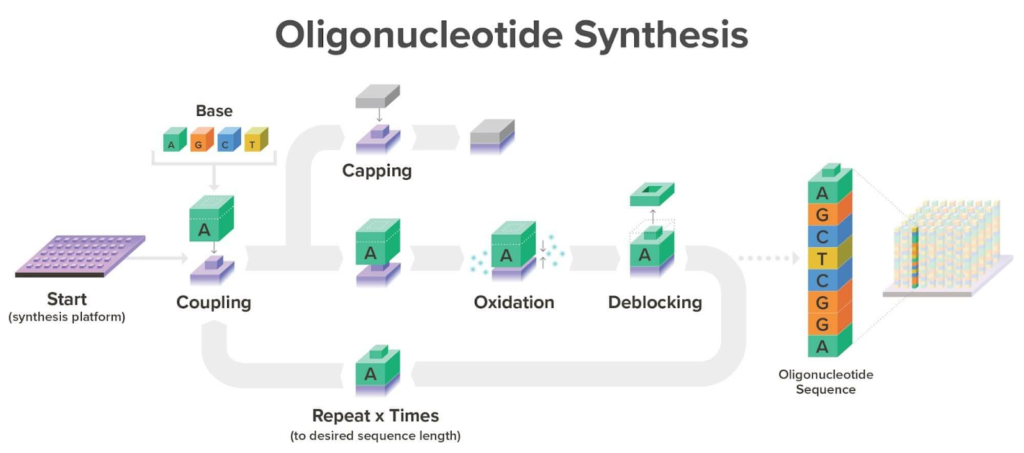
Twistのホスホロアミダイト反応サイクル 開始(カップリング):最初のホスホロアミダイトが触媒付きの縮合反応によって固体表面に結合(小指をつなぐイメージ)。酸化:ホスファイトトリエステルは不安定なため、リン酸に変換して配列の安定性を確保(しっかり手を握るイメージ)。脱保護(デブロッキング):酸性条件下で5’保護基を除去。カップリング:新しいホスホロアミダイトが、直前に脱保護された分子の –OH 基と触媒反応で結合。キャッピング:カップリング効率は100%ではないため、反応に失敗した配列はエラーの原因になる。これを防ぐため、不活性基を付加して以降の伸長を遮断。反復:酸化→カップリングのサイクルを繰り返し、望む配列のオリゴヌクレオチドを伸長。
シリコンDNA合成技術とホスホロアミダイト化学は相互依存ではありません。ホスホロアミダイトケミストリーは今日のゴールドスタンダードですが、シリコンには新しいDNA合成技術が登場した際に柔軟に適応できる特性があります。Twistは確立された商業インフラを持ち、将来さらにスピード・スループット・コストを改善できる技術が登場すれば、容易に組み込むことが可能です。
私たちは、研究者が世界を変える力を得られるよう支えるDNA合成の商業エンジンを築き上げました。
すでに研究者たちは、大規模DNA合成へ容易にアクセスできるメリットを実感しています。たとえば、ゲント大学の研究チームはTwistのサービスを活用し、lncRNAシーケンスの取り組みを強化しました。また、Microsoft Researchとワシントン大学との共同研究では、私たちのオリゴヌクレオチドがデータストレージのツールとして利用されています。
私たちは次世代シーケンス向けに新しいカスタム二本鎖DNAターゲットキャプチャーパネルを合成し、致死性ウイルスのより正確な検出に貢献しています。さらに研究者たちは、CRISPR実験に用いるガイドRNAライブラリの生成にも私たちのオリゴヌクレオチドを活用し、複雑な細胞プロセスの理解を深めています。
Twistのオリゴヌクレオチドは、機械学習アルゴリズムの学習や検証にも欠かせないツールになりつつあります。抗体最適化や遺伝子制御領域の解析など、機械学習には高品質な実験データに基づく確かなグラウンドトゥルースが必要です。私たちのMultiplex Gene Fragmentsは、抗体の相補性決定領域バリアントを直接合成・検証することを可能にします。
加えて、Twistの遺伝子ライブラリは膨大なバリアントを含み、他の手法に比べて最大5倍もの有用分子を特定できることが示されています。これにより、より効率的なタンパク質・抗体工学が可能になります。さらに、私たちは「高速合成」にも対応しており、研究者が必要なデータをこれまで以上に迅速に手に入れられるようにしています。
私たちは合成DNAを通じて、健康と持続可能性の分野における最先端の発見を推進することに尽力しています。そしてその成功の多くは、ホスホロアミダイトケミストリーという美しい技術に支えられています。
Cover image: An artist’s rendition of the DNA double helix (Adobe Stock)

